드디어 코로나-19 mRNA 예방 백신의 임상시험 계획서의 승인 요청을 하였다는 공시가 올라왔다.
6월 말에 임상 신청을 할 것이라고는 했지만 ,말일 오후에 공시를 낼 줄은 몰랐다. 사실 며칠은 일찍 내지 않을까 내심 생각했기에.
아마도 당뇨망막증 치료제의 유럽 임상 2a상의 임상 계획 설계에서 부족한 점이 있어서 임상 프로토콜을 변경했던 경험 때문에, 가급적 신중하게 임상 시험 준비를 한 것이 아닐까 그렇게 생각해 본다.
투자판단 관련 주요경영사항
| 1. 제목 | 아이진 mRNA 기반 코로나-19 예방백신 (EG-COVID) 국내 임상 제 1/2a상 시험 계획 (IND) 승인 신청 | |
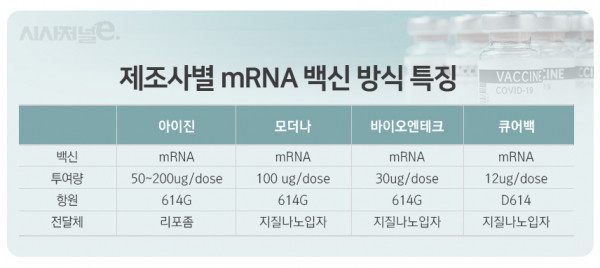
| 2. 주요내용 | ※ 투자유의사항 임상시험 약물이 의약품으로 최종 허가 받을 확률은 통계적으로 약 10% 수준으로 알려져 있습니다. 임상시험 및 품목허가 과정에서 기대에 상응하지 못하는 결과가 나올 수 있으며, 이에 따라 당사가 상업화 계획을 변경하거나 포기할 수 있는 가능성도 상존합니다. 투자자는 수시공시 및 사업보고서 등을 통해 공시된 투자 위험을 종합적으로 고려하여 신중히 투자하시기 바랍니다. 1) 임상시험 제목 - 건강한 성인을 대상으로 COVID-19 예방을 위한 ‘mRNA SARS-CoV-2 백신 (EG-COVID)'의 안전성, 면역원성을 평가하기 위한 1/2a상 임상시험 2) 임상시험 단계 - 제1/2a상 임상시험 3) 대상질환명(적응증) - COVID-19 감염 예방 4) 임상시험 신청일 및 시험기관 -임상 신청일 : 2021년 06월 30일 -임상 승인기관 : 식품의약품안전처(MFDS) -임상시험 접수번호 : 20210179137 (프로토콜 No. : EG-COVID-101) -임상 시험기관 : Step1 : 서울아산병원 단일기관 Step2 : 다기관 (추후확정) 5) 임상시험의 목적 : - Step1: 만 19~54세 건강한 성인을 대상으로 EG-COVID 투여 후, 계획한 모든 용량군에서의 안전성 및 내약성을 평가하고, Step 2 (Phase 2a)에 적합한 용량을 설정함. - Step2: 만 19~85세의 건강한 성인 및 고령자를 대상으로 EG-COVID 투여 후 안전성 및 면역원성을 평가함. 6) 임상시험 시행 방법 - 환자 규모 : Step1; 45명 / Step2; 125명 - 실시 방법 : Step1에서 총 45명의 대상자를 3개군으로 나눠 mRNA 용량 기준 50㎍,100㎍,200㎍을 총 2회 단계적 투여 후 안전성 및 면역원성을 1차 확인하고, 결과를 분석하여 적합한 2가지 용량을 선정한 뒤 125명을 대상으로 Step2 임상을 수행 7) 기대효과 - 당사가 개발하고 있는‘EG-COVID'는 유럽발 변이 바이러스‘D614G'를 기반으로 디자인된 mRNA를 포함하고 있으며, mRNA 전달체로서 자체 개발한 양이온성리포좀을 활용하고 있음. - 현재 상업화된 mRNA백신의 mRNA 전달체‘지질 나노 입자(Lipid Nano Particle,LNP)’에 포함된‘폴리에틸렌글라이콜(PEG)’성분은 전신알레르기 반응인‘아나팔락시스'의 원인으로 추정되고 있음. 이에 비해 아이진의‘EG-COVID’의 전달체인 양이온성리포좀에는‘PEG’가 포함되어 있지 않으며, LNP 대비 국소발현 효과가 더 우수하기 때문에 LNP 기반의 mRNA 백신보다 안전성이 더 높을 것으로 기대할 수 있음. 이 밖에도 ‘EG-COVID’는 동결건조 제형으로 생산, 보관할 수 있기 때문에 2~8℃ 냉장보관이 가능한 장점이 있음. 이러한 장점은 국내 유통은 물론, 일부 선진국을 제외한 초저온 냉동보관 시스템 확보에 어려움이 있는 해외시장에 기술수출 혹은 완제품 수출 추진시 경쟁력 제고에 큰 도움이 될 것으로 기대됨. 8) 향후계획 - 당사는 본 임상 과정에서 확인되는 안전성 및 면역원성의 평가결과에 따라 다음 단계 임상시험에 진입할 계획임. |
|
| 3. 사실발생(확인)일 | 2021-06-30 | |
| 4. 결정일 | 2021-06-30 | |
| - 사외이사 참석여부 | 참석(명) | - |
| 불참(명) | - | |
| - 감사(사외이사가 아닌 감사위원) 참석여부 | - | |
| 5. 기타 투자판단과 관련한 중요사항 | ||
| - 상기 신청일자 및 사실발생(확인) 일자는 식품의약품안전처(MFDS)에 임상시험 계획 승인(IND)을 신청 접수한 날짜입니다. - 본 공시 내용은 향후 당사의 보도자료 및 IR 자료로 사용될 예정입니다. |
||
| ※ 관련공시 | - | |
어찌되었든 간에 순수 국내 기술의 코로나-19 mRNA 백신 개발의 첫 발을 내디었다.
식약처의 승인 절차가 이루어져야 본격적인 임상시험을 시작할 수 있는 것이지만, 대상포진 백신 1차 임상의 Reference가 있기 때문에 승인은 무난하게 받을 것으로 생각한다. 그러면 mRNA 백신 국내 최초 임상시험 시작이라는 타이틀은 아이진이 가져 가게 된다.
그리고 임상 1/2a 상의 결과 또한 잘 마무리 되지 않을까 싶은데, 중요한 임상 2b/3상은 국내에서 진행이 가능할지, 비교임상을 어떻게 진행할지 등의 추이를 잘 살펴볼 필요는 있을 것 같다.
어제 K-mRNA 컨소시엄(GC녹십자, 에스티팜, 한미약품)을 구성해서 2년 내 백신 개발하겠다는 내용의 기사를 보았는데, 역시 메이저급 제약 바이오 기업들은 대우가 다르다는 생각이 문득 들었다.
아무쪼록 다양한 mRNA 백신이 개발되면 좋은 것이니까, 화이팅하라는 말 해주고 싶다.
기사를 찾다보니, 오늘 아이진 임상 신청 기사에 아래와 같은 아이진 관계자의 인터뷰 내용이 있었는데, 읽으면서 속이 후련~하다.
아이진 관계자는
“아이진은 컨소시엄에 들어가지 않아도 자체 기술로 개발과 생산이 가능하다. 현재는 컨소시엄에 들어갈 계획이 없다”
“다만 향후 상황에 따라 컨소시엄에 들어갈 여지는 있다”
고 말했다.
출처 : 시사저널e - 온라인 저널리즘의 미래(http://www.sisajournal-e.com)


유상증자 및 무상증자 증권 발행까지 된, 계좌를 보고 싶다.

'보유종목 & 분석 > 아이진' 카테고리의 다른 글
| [공시] 아이진 - 당뇨망막증치료제 ‘EG-Mirotin’ 국내 2상 임상시험 완료 (0) | 2021.07.15 |
|---|---|
| [기사] 국내 첫 mRNA 성과 보인 아이진, 화이자·모더나와 차별점은? (7/3) (0) | 2021.07.07 |
| [공시] 아이진 - 증권발행 실적 보고서 (6/25) (0) | 2021.06.28 |
| [공시] 아이진 - 대상포진 예방백신 ‘EG-HZ’ 호주 임상1상 시험 완료 (0) | 2021.06.14 |
| 아이진의 면역증강제 "CIA09" (0) | 2021.06.10 |



